联系我们 +
 服务热线
0755-89260762
服务热线
0755-89260762
863检测 · 总部
电话:18025380270 邮箱:863test@sz863.com 地址:深圳市龙岗区坪地街道坪西社区龙岗大道(坪地段)1001号通产丽星科技产业园厂房一B201厂房二101、201骨科植入物的洁净度解决方案
骨科植入物洁净度是评估其生物相容性和对灭菌过程微生物负载控制的关键步骤。而清洗通常作为一项关键工序用于去除前道加工过程中残留的污染物,可以通过机械、物理或化学等方式实现,其中产品表面的化学性质、污染物的化学性质、清洗工艺、产品设计(如组装件、盲孔、深长孔等会增大清洗难度)、产品表面的大小和孔隙率等都会影响产品清洁的难易程度。
清洁工艺设计、确认和风险管理的关系
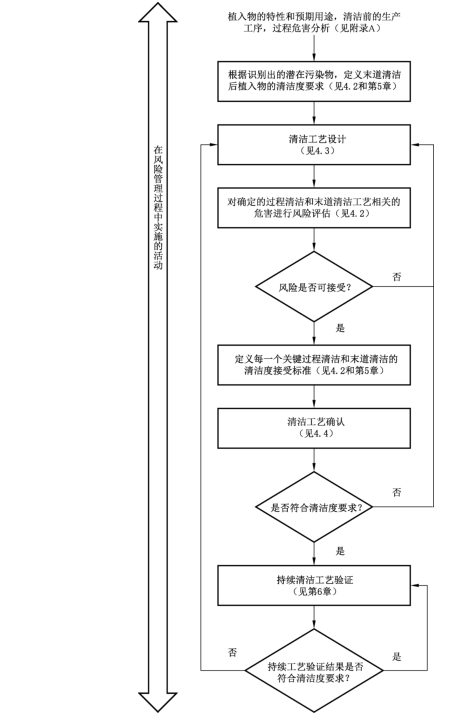
清洁度评估流程
01、清洗过程的设计
产品的清洗过程应进行充分的设计,以达到预先设定的洁净度接受标准。制造商应根据产品的加工工艺进行风险分析,合理设计关键过程清洗和最终清洗的工序位置,并进行验证和确认,以降低污染风险。
02、清洗过程的确认
关键过程清洗和最终清洗都应该经过确认,以证实过程能够持续产生符合洁净度要求的产品。
03、抽样、加工和检测
在清洗过程的风险分析过程中应建立合适的抽样方案,适用时,抽样方案应基于合理的统计学原理来确定样本的数量。当在最差条件下进行确认时,每个最差条件均应进行测试。当建立过程重现性时,至少应测试3个清洗批次。
04、洁净度评估
测试方法和洁净度接受标准。
评估项目:目视/生物负载/细菌内毒素/有机污染物/无机污染物/细胞毒性。
05、持续过程验证
为确保能够达到预期的洁净度要求,对于关键过程参数和环境的日常监控是必不可少的。
清洁度评估项目
测试项目
使用标准
目视检验:制造商应建立清洗后的目视检验接受标准
EN 13018
生物负载:如果清洗过程的目的之一是用于降低产品表面的生物负载,那么应根据ISO 11737-1进行生物负载测试。预期的生物负载水平应足够低,以确保灭菌方法可以达到预期的无菌保证水平。
ISO 11737-1
GB/T 19973.1
细菌内毒素:如果清洗过程的目的之一是用于降低细菌内毒素污染,那么应采用经过确认的测试方法进行细菌内毒素检测。如果采用鲎试剂(LAL)的测试方法,应根据药典中的方法进行。每件植入物的细菌内毒素水平不应超过20 EU。
USP 85
YY/T 0618
《中华人民共和国药典》( 2020 年版)四部第 1143 章
有机污染物:对于有机污染物的化学分析方法有很多种,选择方法时应考虑植入物上的污染类型、植入物材料的类型和分析方法的灵敏度。通常可以采用总有机碳(TOC)或其他适用方法来检测水溶性的有机污染物,采用总碳氢化合物(THC)或其他适用方法来检测溶于非极性溶剂的碳氢化合物(除非碳氢化合物的污染没有风险)。NFS94-091 中的限值( TOC 每件 0.500 mg , THC 每件 0.500 mg )
THC:ISO 10993-12&EPA 8015C-2007
TOC: ISO 10993-12&USP<643>
《中华人民共和国药典》( 2020 年版)四部规定的第 0682 章的方法或 EN1484 描述的方法
无机污染物:重金属(砷,镉,铅,汞)
ISO 10993-12&ICP-MS USP<233>
微粒污染
AAMI TIR42
细胞毒性
ISO 10993-5
GB/T 16886.5
浸提液和浸提时间的选择
测试项目
浸提液
浸提时间
有机污染物:
TOC
纯水
a)(37±1)℃ (72±2)h;
b)(50±2)℃ (72±2)h;
c)(70±2)℃ (24±2)h;
d)(121±2)℃ (1±0.1)h。
THC
非极性溶剂正己烷或卤化溶剂
无机污染物:
纯水、含酸的水、或其他适当溶剂
备注:
1.第一次浸提后, 当浸提量低于定量限时, 能认为已达到极限浸提。
2.在对清洁度进行最终测试前,应选择最差情况下的样品对极限浸提进行验证。
样品浸提比例的选择:
|
厚度 (mm) |
浸提比例(表面积或质量/体积)±10% |
材料形态举例 |
|
<0.5 |
6 cm²/mL |
膜、薄片、管壁 |
|
0.5~1.0 |
3 cm²/mL |
管壁、厚片、小型模制件 |
|
>1.0 |
3 cm²/mL |
大型模制件 |
|
>1.0 |
1.25 cm²/mL |
弹性密封件 |
|
不规则形状固体器械 |
0.2 g/mL |
粉剂、球体、泡沫材料、无吸收性模制件 |
|
不规则形状多孔器械(低密度材料) |
0.1 g/mL |
薄膜、织物 |
注:现在尚无测试吸收剂和水胶体的标准化方法,推荐以下方案:
· 测定材料浸提介质吸收量(每0.1 g 或 1.0 cm² 材料所吸收的量);
· 在进行浸提时,对浸提混合物按每0.1 g 或 1.0 cm² 额外加入该浸提介质吸收量。
测试样品需求及测试周期:
|
测试项目 |
周期 |
样品需求 |
|
目视检验 |
1周 |
5个样 |
|
生物负载 |
2周 |
10个样(灭菌前独立包装) |
|
细菌内毒素 |
2-3周 |
8个样(灭菌后独立包装) |
|
有机污染物: |
1-2周 |
10个样 |
|
1-2周 |
||
|
无机污染物: |
1-2周 |
|
|
微粒污染 |
2周 |
5个样 |
|
细胞毒性 |
2周 |
1-2个样 |
相关标准:
GB/T 44876-2024外科植入物 骨科植入物的清洁度 通用要求
ISO 19227-2018外科植入物 骨科植入物的清洁度 通用要求
GB/T 16886.12-2017 医疗器械生物学评价 第12部分:样品制备与参照材料
ISO 10993-12-2021医疗器械的生物学评价 第12部分:样品制备和参考材料
实验室配置:
实验室配置了AAS、GFAAS、ICP-AES、ICP-MS、UV-VIS、IC、GC、GC-MS、LC、LC-MS/MS、TOC、LPC等多套精密检测设备。可以满足ISO 19227-2018《骨科植入物的清洁度》和《GB/T 44876-2024外科植入物 骨科植入物的清洁度 通用要求》测试。

解决方案
863检测具备丰富的骨科植入物的清洁度测试经验,协助医疗生产设计企业满足ISO和GB标准要求,尤其在元素分析、阴离子分析等方面有先进前处理方法,确保结果的准确性。863检测拥有专业的技术团队和丰富的医疗器械测试经验、完善的服务内容和服务网络,能为企业提供专业的咨询和测试服务。











